Što radi genetičar? Kojim bolestima se bavi genetičar? Kako dijagnosticirati nasljedne bolesti
Liječnik se bavi otkrivanjem nasljednih bolesti i kvarova u kromosomima. Najoptimalnije vrijeme za kontaktiranje genetičara je planiranje trudnoće, jer će se u ovom slučaju provesti pravovremena prevencija različitih bolesti koje djeluju na genetskoj razini. Doktor genetičar će obaviti sve što je potrebno da ne dođe do prekida trudnoće i da se ne pojave neke patologije.
Što spada u kompetencije genetičara?
U pravilu, projektni zadatak genetike uključuje obavljanje niza funkcija - to je postavljanje ispravne dijagnoze i razmatranje nasljednih osobina koje se prenose na genetskoj razini i izračun stupnja rizika jednog ili drugog, kao i objašnjenje svih ovih čimbenika obitelji koja je išla liječniku. Genetičar za bračni par provodi neke preglede koji uključuju pretrage i isključuju razvoj određenih bolesti kod djeteta.
Kojim bolestima se bavi genetičar?
Područje djelovanja liječnika Genetika uključuje veliki broj bolesti, od kojih su glavne sljedeće:
- Razne bolesti koje imaju autosomno dominantan, -recesivan, X-vezan tip nasljeđivanja;
- Bilo koja vrsta genomike i eugenike;
- Razni sindromi - adrenogenitalni, mikrocitogenetski, Wolf-Hirshhorn, Down, disomija, mačji krik, mentalna retardacija i tako dalje;
- Nasljedne predispozicije djeteta za alkoholizam, razne mutacije i ljudska genetika općenito;
- Osim toga, genetičar se bavi sastavljanjem rodovnice i utvrđivanjem stupnja rizika od određene bolesti.
Kojim se organima bavi genetičar?
Liječnik ne liječi niti jedan određeni organ, on utvrđuje prirodu bolesti u cjelini na genetskoj razini.
Kada biste trebali posjetiti genetičara?
Preporuča se javiti se genetičaru ako je roditeljima vrlo bitan spol nerođenog djeteta, kao i ako obitelj već ima jedno dijete s genetskim odstupanjima. Također se trebate prijaviti ako su u obitelji jednog od supružnika već rođene osobe s genetskim bolestima, kao i ako je brak u krvnom srodstvu.
Postoje i slučajevi obraćanja genetici majki nakon 35 godina iu slučajevima kada je već bilo rođenja mrtve djece ili pobačaja.
Kada i koje pretrage treba napraviti?
Kada se obratite genetičaru, potrebno je proći niz testova koji će vam pomoći identificirati gen koji je odgovoran za nastalu bolest.
Koje su glavne vrste dijagnostike koje obično provodi genetičar?
Liječnik genetičar provodi brojne dijagnostike usmjerene na identifikaciju gena.
VIDEO
Na to da se beba rodi zdrava, utjecat će okolina, koja bi stoga trebala biti povoljna najbolje vrijeme Godina začeća djeteta je ljeto-jesen, kada je zrak najsvježiji, a raste puno povrća i voća koje nije bilo podvrgnuto nikakvoj preradi. Osim toga, u ljetno-jesenskom razdoblju nema virusnih bolesti.
Najpovoljnija dob za žene za rađanje djece je između 18 i 35 godina. Ako se trudnoća dogodi ranije ili kasnije od tog razdoblja, potrebno je hitno podvrgnuti pregledu kod genetičara.
Također je vrlo važno imati informacije koje se barem na neki način odnose na povijest bolesti i zdravlje obitelji oca i majke nerođenog djeteta. Većina parova griješi kada ne koristi usluge genetičara, pa na svoju djecu prenose neke genetske bolesti i nedostatke. Vrlo često opstetričar preuzima dio odgovornosti, razgovarajući s brojnim parovima o genetskim problemima.
Najpovoljnije razdoblje za obraćanje genetičaru je razdoblje planiranja djeteta, a još bolje ako se mladi par posavjetuje s liječnikom i prije braka. Ako se dogodilo da je žena već u poziciji, tada će genetičar predložiti mjere usmjerene na provođenje prenatalnih testova koji će pomoći u određivanju zdravlja djeteta. Također, roditelji će moći donijeti konačnu odluku – trebaju li imati djecu. Vrlo često je bilo takvih slučajeva kada su najobičnije preporuke genetičara spasile parove koji su imali visokog rizika djece s patologijama.
Dakle, svaki mladi par trebao bi se posavjetovati s genetičarom ako postoji rizik od nezdrave djece. Također je potrebno kontaktirati ovog liječnika kako bi se spriječila bolest kod budućeg potomstva, što će mlade roditelje spasiti od brojnih problema.
Mikhail Skoblov, voditelj Laboratorija za funkcionalnu genomiku u Medicinsko-genetičkom istraživačkom centru, govorio je o tome do čega će istraživanja u području medicinske genetike na kraju dovesti i zašto će prva "uređena" osoba vjerojatno biti rođena u Kini.
Počet ću vam ukratko reći o sebi. Više od deset godina radim u Medicinsko-genetičkom istraživačkom centru koji se bavi genetskim bolestima čovjeka - kako su raspoređene, koji su uzroci - te razvija različite pristupe njihovoj dijagnostici i liječenju. Također radim na Moskovskom institutu za fiziku i tehnologiju, gdje dobri uvjeti za bavljenje znanošću. U MIPT-u me prvenstveno zanimaju studenti - talentirani momci koji već sada mogu postati sudionici znanstvenog procesa, posebice procesa pomoći veliki iznos podataka koji se nastavljaju gomilati u području biologije i medicinske genetike.
Što je medicinska genetika? Jedno od jednostavnih objašnjenja: riječ je o znanosti koja se bavi rasvjetljavanjem uloge gena u nastanku patologija kod ljudi. Kao što je poznato iz školskog tečaja, sva genetika dolazi od Mendela (Gregor Johann Mendel - austrijski botaničar, augustinski redovnik, utemeljitelj teorije nasljeđivanja. - Rjedinice); i tako, isti klasični zakoni nasljeđivanja, koje je on propisao, leže u osnovi moderne medicinske genetike.
Počnimo s nasljednim bolestima. Reći ću vam kako su pronađeni, kako su opisani, kako su proučavani. Općenito, ovo je prilično teško pitanje. Izolirajte genetske bolesti dugo vremena neuspjeh. Ovo nije nimalo lak zadatak. Ali glavni kamen temeljac medicinske genetike je razumijevanje nasljeđa bolesti. I to na temelju takozvane genealogije pacijentove obitelji.
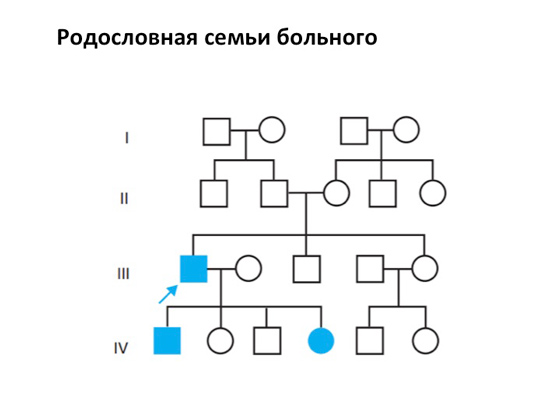
Kvadrati u takvim "rodovnicama" uvijek označavaju mužjake, krugove - ženke. Ovdje imaju djecu koja također mogu dati potomstvo, i tako dalje. I u nekoj generaciji pojavi se jedan oboljeli član obitelji, a jasno je da se njegova bolest nekako može naslijediti. I tu dolazi sama genetska komponenta koja se može izolirati, slikati i medicinska genetika već može početi raditi s njom.
Prva izolacija genetske komponente dogodila se relativno nedavno - 1966. godine. Bio je jedan znanstvenik, Victor Almon McKusick, koji je napravio katalog autosomno dominantnih, autosomno recesivnih i X-vezanih fenotipova (to jest, kako ljudi izgledaju, kako se bolesti manifestiraju u njima). I od tada cijeli svijet istražuje i prikuplja podatke o tome kako izgledaju genetske bolesti, kako djeluju. Do danas ih je mnogo opisano - više od osam tisuća. Postoji online baza podataka OMIM (na liniji mendelovski Nasljedstvo u čovjek), u kojoj svaki znanstvenik, ako je obavio kompetentno istraživanje, može ostaviti zapis i time obogatiti znanost.
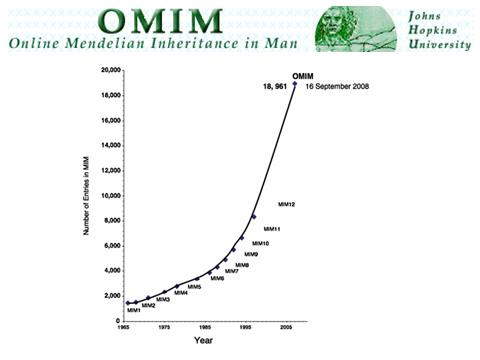
Neke su bolesti vrlo dobro poznate – znamo njihovu molekularnu osnovu i razumijemo od čega dolaze. Za neke još uvijek nema dovoljno informacija. A za neke bolesti samo se pretpostavlja da mogu biti genetske. Ali ovo je najvažniji temelj medicinske genetike: imamo opise bolesti koji su do danas napravljeni i sada se mogu proučavati.
Općenito, monogene bolesti - to jest, kada kvar gena dovodi do bolesti - manifestiraju se u ranom djetinjstvo. Većina njih - gotovo 90% - dijagnosticira se u djetinjstvu. Manje od 10% pojavljuje se nakon puberteta, a samo 1% na kraju reproduktivnog razdoblja. Logika je jasna: ako se dogodi neka vrsta sloma u genetskom materijalu, neki protein prestane funkcionirati, tada su, u pravilu, manifestacije tog sloma vidljive od prvih dana života, a vrlo često čak i u maternici. Ali ako se zbroje sve bolesti, onda - u slučaju monogenih bolesti, kada kvar na jednom genu dovodi do jedne bolesti, učestalost njihove manifestacije je 0,36%. Reći ću to drugačije: od tisuću ljudi samo četvero prijeti da budu vlasnici genetske bolesti. Ali sve te bolesti proučavaju se na najdetaljniji način. Koje su to bolesti? U Rusiji su najčešći sljedeći:
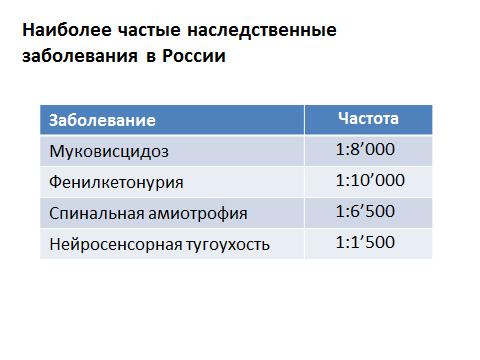
Za cističnu fibrozu: jedan pacijent javlja se na osam tisuća ljudi. Za fenilketonuriju: jedan od deset tisuća. To je najviše česte bolesti- također je rijetko. Ali ukupno imamo prilično veliku brojku.
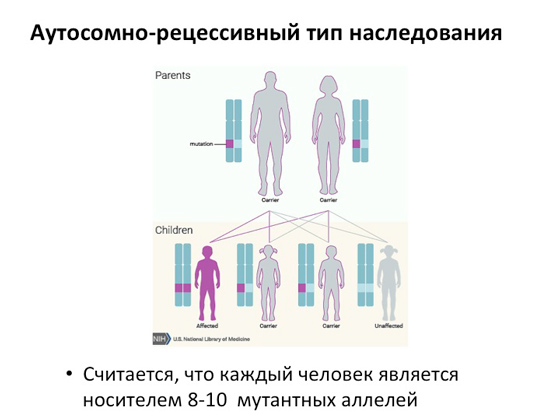
Svatko od nas ima dva seta kromosoma: jedan dolazi od tate, drugi od mame. U slučaju autosomno recesivne bolesti, svaki od roditelja može nositi kvarove gena u jednom kromosomu - jedan kvar u majčinom, drugi u očevom. Sukladno tome, kada dobiju djecu, moguće su tri opcije: rodi se bolesno dijete, kod kojeg su polomljene dvije kopije gena, rađa se dvoje djece, a svako ima po jedan kvar, ili dijete koje nema niti jednu pokvarenu kopiju gena. gen. Odnosno, u slučaju autosomno recesivne bolesti kod potomaka, samo jedno dijete može imati obje kopije pokvarenih gena, zbog čega dolazi do bolesti. Smatra se da u prosjeku u populaciji svatko od nas može biti nositelj osam ili čak deset mutantnih alela (tj. različite forme isti gen). Odnosno, možemo (ne daj Bože, naravno) sresti partnera koji će imati kvar na istom genu, a to će dovesti do toga da će se djeca rađati po ovoj raspodjeli. Autosomno recesivno nasljeđivanje javlja se u gotovo polovici svih ljudskih genetskih bolesti.
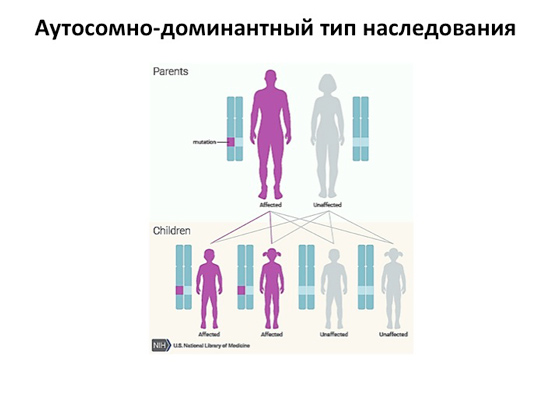
Druga opcija je autosomno dominantna vrsta nasljeđivanja. Ovdje je slika još jednostavnija: dovoljan je kvar samo na jednoj kopiji gena i dolazi do bolesti. Dakle, ako imamo jednog bolesnog roditelja, onda će ovu bolest očito s 50 posto vjerojatnosti naslijediti njegova djeca. Zašto je jedno nasljedstvo, a drugo tamo? Pa tako geni funkcioniraju. Ponekad je gen toliko važan da njegov nedostatak uzrokuje pojavu bolesti. I događa se da je kod djece ili kod samih roditelja pola kopija gena normalno, pola s mutacijom, ali se aktivira kompenzacijski mehanizam koji pomaže tijelu da se nosi s tim, a bolest se nikako ne razvija .
Odakle dolaze ti vrlo oštećeni geni s tim mutacijama? Jasno je da imamo DNK u našim stanicama, a ta DNK je jako, jako velika. Tri milijarde nukleotida! Sukladno tome, kada se stanice dijele, bez obzira na to koliko je precizan proces diobe, dolazi do pogrešaka. Unatoč tome što u stanicama imamo mehanizme koji paze da ne dođe do pogrešaka, pa čak i popravljaju neispravne zamjene, dio mutacija se ipak događa i nasljeđuje se. I dugo vremena nije bilo jasno: koliko se često to događa, kako sve to funkcionira? I tek nedavno - doslovno u posljednjih nekoliko godina - objavljeno je nekoliko vrlo snažnih znanstvenih radova. Genomi zdravih i bolesnih ljudi potpuno su sekvencirani kako bi se moglo procijeniti kako nastaju nove mutacije u odnosu na prvu i drugu generaciju, a pokazalo se da djeca u prosjeku od oca nasljeđuju četrdesetak nekih novih promjena. Odnosno, nema tih promjena u genomu oca, ali se pojavljuju kod djeteta. I, što je najzanimljivije, u istim se radovima pokazuje da što je otac stariji, to se veća oštećenja u njegovom DNK prenose na potomstvo. Usput, ovo se ne odnosi na žene. U prosjeku se s majke na dijete prenosi oko deset do dvadeset zamjena, ali taj broj ne ovisi o dobi majke. Ponovit ću opet. Radi se o tome da ako uzmemo dvoje apsolutno zdravih ljudi i oni imaju dijete, tada će beba imati četrdesetak novih zamjena od oca i dvadesetak novih zamjena od majke, odnosno imat će šezdesetak zamjena u genomu koje roditelji nemaju.. I jasno je da se tih šezdeset promjena može locirati bilo gdje. Mogu biti u nekim važnim genima, ili mogu biti u genima koji uopće nemaju smisla. Ali uvijek postoji mogućnost da te promjene ipak mogu oštetiti neki gen i izazvati bolest autosomno recesivnog tipa ili autosomno dominantnog tipa. A s tim ne možemo učiniti baš ništa - tako funkcionira priroda. I još uvijek je prilično savršena. Zamislite samo: tri milijarde nukleotida se udvostruči tijekom diobe stanice, a sve je to prilično kompliciran, velik proces, au tom slučaju može se dogoditi samo četrdesetak pogrešaka. Tih bolesti uvijek je bilo, ima i bit će ih se čovječanstvo ne može riješiti. Ali najvažnije - a to je ono što medicinska genetika radi, na što se fokusira - sada imamo DNK dijagnostiku.
![]()
Zašto se dijagnosticiraju genetske bolesti? Prije svega, da bi čovjek shvatio svoju sudbinu. Kad je čovjek od nečega bolestan, znanje i samo razumijevanje prirode te bolesti – kako djeluje, zašto je nastala – psihički znatno olakšava život. Drugo i često najviše važna točka: Potrebna je DNK dijagnostika kako bi se znanjem moglo planirati rađanje zdrave djece. A sada ću vam reći kako to radi.
Mnogo je genetskih bolesti, a razlozi zbog kojih nastaju također su brojni. Prva istraživanja ovih uzroka izgledala su vrlo jednostavno: sve što su znanstvenici mogli učiniti prije 50-60 godina bilo je pogledati kroz mikroskop i vidjeti kako su ljudski kromosomi raspoređeni. A danas znamo da čovjek ima 23 para kromosoma. Sve novonastale anomalije u odnosu na ovu normu znanstvenici registriraju, opisuju i povezuju s nekom vrstom genetske bolesti. Evo slike koju je lako razumjeti ako pažljivo pogledate što nije u redu s njom.
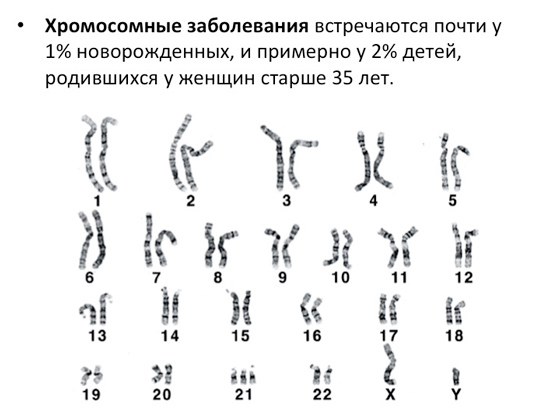
Lako je vidjeti da 21. kromosom ima tri kopije umjesto dvije. Ne primijetiti ga u mikroskopu čak je i za učenika teško. I jasno je da takvo abnormalno povećanje broja kopija kromosoma - kao i, naprotiv, smanjenje - dovodi do bolesti. Isto vrijedi ako je kromosom na neki način pretjerano dugačak ili postaje kraći. Odatle dolaze kromosomski poremećaji. Oni predstavljaju vrlo veliku skupinu - oko 1% novorođenčadi ima takve patologije (i oko 2% djece se rađa s kromosomskim patologijama kod žena starijih od 35 godina; naravno - tako funkcionira biologija - s godinama neki procesi počinju raditi lošije , uključujući embrionalni razvoj i mnogo više). Opća statistika kromosomske abnormalnosti složeni na vrlo zanimljiv način. Na svakih 10 tisuća trudnoća koje se mogu statistički analizirati, imamo oko 9 tisuća s normalnim kromosomima i oko 800 slučajeva s patologijama. A među tih 800 - tako je opet priroda uređena - samo 50 slučajeva dovodi do toga da se rađaju djeca, ima nekih anomalija. Preostale trudnoće, u pravilu, zamrzavaju se, ne razvijaju se i završavaju spontani pobačaji. S jedne strane, ovo je dobro. Priroda razumije da treba postojati normalan skup kromosoma, a ako nešto nije u redu - ima više, manje kromosoma, neki važni fragmenti su izgubljeni, - pokreću se procesi na staničnoj razini koji zaustavljaju trudnoću. S druge strane, u nekim slučajevima trudnoća se nastavlja, bez obzira na sve. Jedan od najpoznatijih primjera je trisomija 21, koja dovodi do Downovog sindroma.
Naravno, danas ih ima različiti putevi izbjegavaj sve ovo. Mikroskopska metoda praćenja kvantitete i kvalitete kromosoma, koja postoji jako dugo i vrlo uspješno, postupno se zamjenjuje modernijom i osjetljivijom metodom pod nazivom “microarray analiza”.
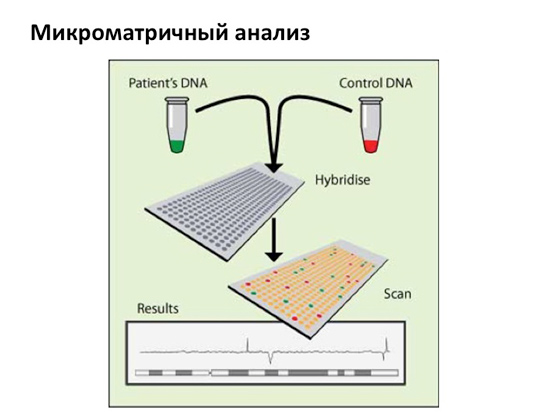
Ukratko ću opisati kako to radi: uzimaju se pacijentova DNK i kontrolna DNK, pripremaju se na lukav način, fluorescentno označavaju i hibridiziraju na posebnim matricama, kao rezultat vidimo kromosome i vidimo fluorescentni signal koji dolazi iz različitih fragmenata pacijentovog DNK. U nekim slučajevima, signal se povećava, a to znači da se kopije gena pojavljuju na ovom mjestu, u nekim slučajevima, naprotiv, nestaje, što znači da je postojao dio gena, ali je nestao. To jest, u jednom slučaju postoji dupliciranje, u drugom - brisanje. Analiza mikromreža vrlo je osjetljiva i pomoću nje se događaji mogu vidjeti s iznimno velikom točnošću.
Međutim, DNA sekvenciranje je bilo i ostalo glavna metoda dijagnoze. Izumio ga je 1980. prekrasni znanstvenik Frederick Sanger, koji je smislio kako odrediti same nukleotide koji čine našu DNK. Do danas je ova vrsta analize puštena u rad, radi se u gotovo svim DNK dijagnostičkim laboratorijima u svijetu. To se radi vrlo brzo, učinkovito, uz pomoć njega možete istražiti pojedine dijelove gena. Grubo rečeno, ovo je glavni stroj medicinske genetike. Potraga za genskim mutacijama pomoću sekvenciranja DNA vrlo je jednostavna: na izlazu dobivamo kromatogram, gdje svaki prasak signala prati određeno slovo. Kada sekvenciramo DNK pacijenta, možemo to pronaći zdrava osoba na jednom mjestu slovo T, a kod bolesnika na istom mjestu - slovo G. Pronalaženje mutacija u nekim određenim genima nije težak zadatak. Glavna stvar je razumjeti gdje tražiti te mutacije.
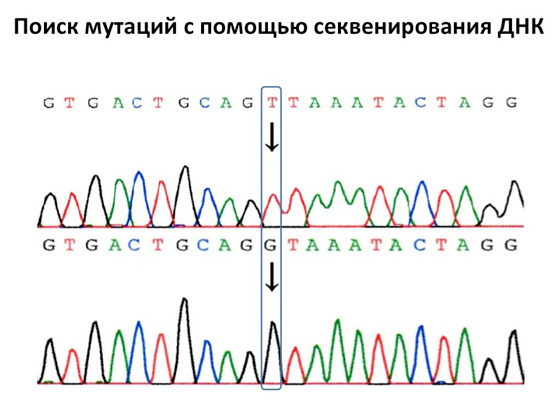
Sljedeći korak u razvoju DNK dijagnostike je masovno paralelno sekvenciranje. Izumljeni su tako moćni strojevi koji mogu odjednom sekvencirati vaš genom, odnosno svi će kromosomi, svi geni biti analizirani i dešifrirani u jednoj analizi. Ova se tehnologija pojavila relativno nedavno i dugo nije radila dovoljno dobro. Danas su sve pogreške eliminirane, a masovno paralelno sekvenciranje jedna je od najtočnijih analiza dostupnih većini ljudi. Svatko ga može napraviti - košta oko 30 tisuća rubalja. Sada strojevi za sekvenciranje izgledaju ovako:

Ali najzanimljivije je da će njih, kao što znanstvenici očekuju (i ispravno čine), u bliskoj budućnosti zamijeniti vrlo mali, vrlo kompaktni mini-sekvenceri koji će biti povezani s USB-luka. Ova tehnologija se trenutno testira - dok još uvijek radi puno grešaka - ali očekuje se da će takav uređaj koštati samo oko 200 dolara i da će izgledati otprilike ovako:

Do neke mjere vrlo dobro, ali u isto vrijeme i loše. Pojava takvih tehnologija sposobnih za ovu vrstu analize dovela je do toga da su u razvijenim zemljama - posebice u Engleskoj i Nizozemskoj - javne bolnice učinile takvu analizu obveznom za sve koji im dođu. I nije važno ima li osoba genetske bolesti ili ne: čim se dogovori s liječnikom, odmah mu se daje sekvenciranje genoma. Ovo je uvedeno 2011. godine - dakle, relativno nedavno - i sada postoji sve više klinika koje prakticiraju ovaj pristup. I sve bi bilo dobro i krasno, ali liječnik u ruke prima različita slova - A, T, G, C, koja mogu slijediti jedno za drugim različitim redoslijedom, a broj tih slova kod svakog od nas je oko tri milijarde. komada.

Najteži zadatak ovog pristupa (sekvenciranje genoma i njegova naknadna analiza) je dešifrirati značenje tog niza, protumačiti ga, razumjeti gdje sadrži mutacije koje uzrokuju bolesti ili sklonost njima, a gdje ne. Čim ljudi nauče razumjeti ovo dekodiranje, "pročitaju" ovu napomenu, odmah će započeti sljedeća faza u razvoju medicinske genetike. Ali dok se to ne dogodi, malo je vjerojatno da će biti korisno ako mini-sekvenceri uđu u naše domove, da tako kažem.
Svijest o ovom problemu počela je s ovo dvoje divnih ljudi. Godine 2007. objavljena su dva rada – paralelno i gotovo istovremeno – u kojima su sekvencirani osobni genomi Craiga Ventera i Jamesa Watsona (da, onog koji je otkrio dvolančanu strukturu DNK, stvarno velikog znanstvenika; kao znak koju je izradio za nauku, uručen mu je takav dar). Općenito, izašla su ova dva rada o sekvenciranju pojedinačnih ljudskih genoma, u kojima su znanstvenici pokušavali izolirati značenje iz tog niza, ali nisu uspjeli. Jer analizom su pronađeni geni odgovorni za određeni fenotip (boja očiju, boja kose) ili odgovorni za pojavu nekih bolesti, ali zapravo te manifestacije nisu pronađene. Ili, obrnuto, Venter i Watson imali su bolesti i različita fiziološka stanja, ali ništa u "sažetku" nije upućivalo na njih. Nastala je praznina. Čini se da znamo slova - A, T, G, C, ali ne znamo kako pravilno protumačiti njihovo značenje. Ovaj jaz još uvijek postoji. Zašto? Budući da je ljudski genom vrlo velik, i ako sekvenciramo DNK bilo koga od nas, završit ćemo s oko tri milijuna nekih individualne razlike koji će nas razlikovati jedne od drugih. Što se svojedobno radilo s Venterom, Watsonom i ostalim nepoznatim ljudima: kad su sekvencionirani, pokazalo se da 3,2 milijuna nukleotida razlikuje Watsona od svih ostalih. I još je jako, jako teško dokučiti jesu li ta tri milijuna važna i koje su karakteristike važnije od drugih. Čak i ako uzmemo ne cijeli genom, ne cijeli dugi slijed DNK, već razmotrimo samo značajna područja koja sadrže gene iz kojih se formiraju proteini koji obavljaju neku funkciju. Takvih regija u genomu ima oko jedan posto. Ukupno, svi oni sadrže od 30 do 70 tisuća genomskih razlika. A utvrditi koji od njih utječu na rad proteina, a koji ne, sa stajališta medicinske genetike, još uvijek je vrlo težak zadatak. Posao polako ide naprijed, a opet u tome pomaže pristup koji je otkriven na samim počecima medicinske genetike, analiza pedigrea pacijenata. Kada nema potrebe uspoređivati DNK ove osobe s DNK drugih ljudi, ali se može usporediti s DNK srodnika, odnosno genetski bliskih osoba. Evo DNK zdravog brata, ali bolesnog - koja je razlika između njih? U ovom slučaju, pronalaženje uzroka bolesti postaje puno lakše.
Takvi su radovi daleko najuspješniji. A evo jednog od njih: dječak je imao neuropatiju, sekvencionirali su genom roditelja i genom dječaka i po razlici između onog što imaju roditelji i onog novog pronađenog kod djeteta, pronašli su mutaciju u gen SLC26A3, i postalo je jasno otkud ova bolest, čak su predloženi i neki načini da se to kompenzira.

99% genetskih bolesti danas je neizlječivo. Ne možemo pomoći ljudima ni na koji način. A ono što medicinska genetika daje samo je prevencija bolesti. Ovdje sam sastavio tako dobro poznatu šaradu - "izlječenje je nemoguće spriječiti", a sada ćemo reći sve što stane pod naslov koji će izaći iz šarade ako iza druge riječi stavimo zarez. To je - "nemoguće je liječiti, upozoriti." A kako upozoravaju? Prvi način: DNA-dijagnostika nošenja mutacija. Evo jednog zanimljivog slučaja koji opisuje koliko je ova metoda učinkovita i ispravna. Postoji takva genetska Tay-Sachsova bolest - vrlo teška, vrlo rijetka. U dobi od oko šest mjeseci djeca doživljavaju zastoj u mentalnom i tjelesni razvoj, vid, sluh, sposobnost gutanja postupno se gube, dijete umire u dobi od oko četiri godine. Poznato je da je mutacija koja uzrokuje bolest u genu HEXA da se radi o autosomno recesivnom tipu nasljeđivanja, odnosno da oba roditelja imaju oštećenu kopiju gena, a dijete nasljeđuje oba oštećenja. Naša egzistencija je tako posložena da su u nekim zemljama koje žive odvojeno i zatvorene takve bolesti vrlo česte. Općenito, u slučaju Tay-Sachsa, to je Izrael. A konkretno Židova Aškenaza. Jedno bolesno dijete na tri tisuće novorođenčadi. Bolest je ozbiljna, a Izrael je država koja brine o zdravlju nacije. Stoga je na državnoj razini uvedeno obavezno testiranje na nositeljstvo mutacije u genu HEXA, a samo nekoliko godina kasnije u Izraelu se počelo rađati samo jedno bolesno dijete u stotinama tisuća. Slična je priča bila i u Finskoj, koja je u posljednjih 300 godina bila vrlo izolirana, slabo u interakciji sa svijetom, a to je dovelo do toga da su određene genetske bolesti kod Finaca postale vrlo česte. Također su uveli program probira za prijenos nekoliko bolesti odjednom - iu vrlo kratkom vremenskom razdoblju sve su aktivno eliminirane.
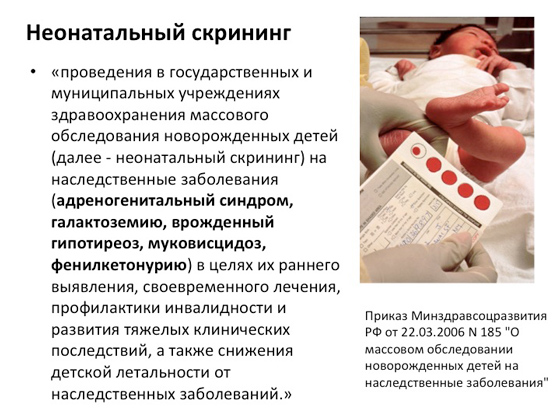
Prije nekoliko godina u Rusiji je također pokrenut program pod nazivom "neonatalni skrining". Naime, čim se dijete rodi, odmah mu se uzme nekoliko kapi krvi iz pete i napravi DNK dijagnostika na najčešće genetske bolesti u nas: adrenogenitalni sindrom, galaktozemiju, kongenitalnu hipotireozu, cističnu fibrozu, fenilketonuriju. . Sve se to radi kako bi se u ranoj fazi razumjelo kako pomoći osobi, što je više moguće kompenzirati patogeni učinak i spriječiti njegov razvoj.
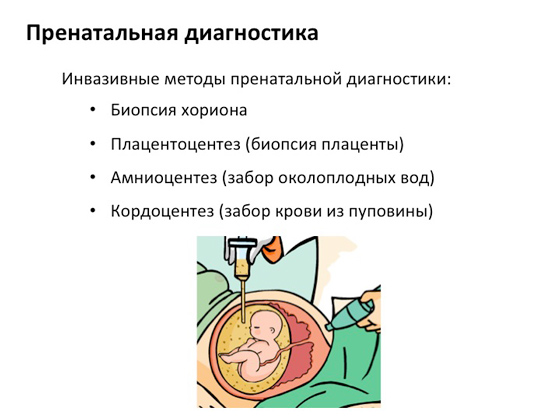
Sljedeća dijagnostička opcija je prenatalna dijagnostika. Na rani datumi trudnoće, pažljivo, bez oštećenja ploda i unutarnjih organa majke, uzimaju neke dijelove koriona, odnosno ovojnice ploda, koji se koriste za genetsku analizu nerođenog djeteta kako bi se shvatilo je li nosi bilo kakve kvarove u svojim genima. Ukoliko se pokaže da su smetnje prisutne, majci se daje izbor da prekine ili nastavi trudnoću. Ovo je vrlo važno - nudi se izbor. Tako funkcionira genetsko savjetovanje: nema strogih pravila, osoba sama odlučuje kako će s tim živjeti.
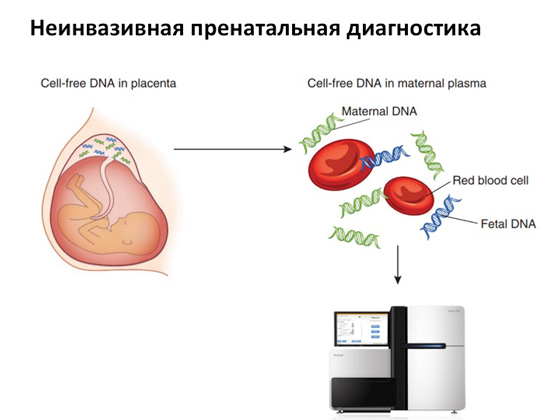
Zahvaljujući pojavi snažnih sekvencera, sada je dostupna neinvazivna prenatalna dijagnostika. Vrlo je zanimljivo uređen. U ranoj fazi trudnoće - na primjer, u desetom tjednu - majci se krv uzima iz vene. Poznato je da tijekom razvoja fetusa neke njegove stanice umiru, njihov DNK se mrvi i ulazi u krvotok majke. A ako uzmete krv od majke i koristite moćni sekvencer, onda uz pomoć posebnih algoritama možete identificirati koja je DNK majke, a koja je fetusa, te vidjeti ima li kakvih supstitucija, mutacija u genomu fetusa. A ako postoje mutacije, onda majka opet ima izbor.
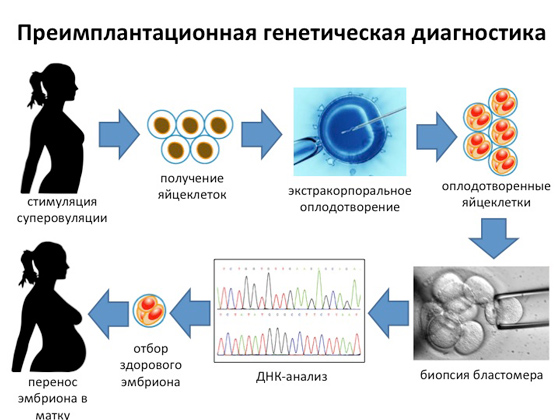
Kruna svih radova današnjih genetičara je takozvana predimplantacijska genetska dijagnostika. Pojavio se nedavno, to je najteža, najdugotrajnija i najskuplja dijagnostička metoda, ali vam omogućuje da u velikoj većini slučajeva dobijete sto posto zdravo dijete. Odmah ću reći da je takva dijagnoza potrebna samo u onim slučajevima kada bračni par dođe u laboratorij i kaže: naše prvo dijete rođeno je s tom i takvom genetskom bolešću, ali želimo da sljedeće bude zdrav. Genetičari analiziraju cjelokupnu obiteljsku povijest, izoliraju gen s određenom mutacijom i razumiju što treba učiniti da nerođeno dijete nema tu mutaciju. Kako se to događa? Kod žene se izaziva superovulacija, uslijed čega se dobiva određeni broj jajnih stanica. Nakon toga se u laboratoriju provodi in vitro oplodnja. Nekoliko dana kasnije iz oplođene jajne stanice odabire se jedna stanica bez oštećenja budućeg embrija, koja se koristi za genetsku dijagnostiku. A ako je moguće dobiti podatak da to oplođeno jajašce nema nikakvih mutacija u fazi blastomera, onda je to jaje koje je usađeno u majku, koja će za devet mjeseci dati potpuno zdravo potomstvo.
Medicinska genetika razvila je mnogo različitih pristupa kako bi stvorila uvjete u kojima je moguće izbjeći pojavu genetskih bolesti, ali, naravno, u slučaju novih mutacija koje dovode do pojave nasljedne bolesti ne možemo ništa predvidjeti. Kao rezultat rađaju se bolesna djeca. A shvatiti da ih treba liječiti (budući da ih se nije moglo upozoriti) vrlo je, vrlo hitan zadatak. I znanost ide u tom smjeru. Glavni problem je što je riječ o osam tisuća bolesti. Nemoguće je čak ni čisto teoretski razviti nekakav univerzalni pristup koji bi omogućio da se u svakom slučaju sve izliječi. Stoga za svaki slučaj genetičari izmišljaju individualna rješenja, individualne tehnologije.
![]()
Evo grafikona koji prikazuje niz terapijskih strategija korištenih u pokušaju liječenja genetskih metaboličkih bolesti. Može se vidjeti da se u nekim slučajevima koristi operacija, u drugima - transplantacija tkiva ili transplantacija koštane srži. Jedan posto zauzima genska terapija kada se isporuči zdrava kopija gena. U nekim slučajevima pokušavaju ograničiti bolest prehranom ili unosom. lijekovi. Općenito, postoji mnogo pristupa.
Što se tiče prehrane, u nekim slučajevima gotovo potpuno uklanja bolest. Dvije dobro poznate bolesti su galaktozemija i fenilketonurija. Prvi je kršenje metabolizma ugljikohidrata, kada enzim koji metabolizira mliječni šećer, nakon mutacije, prestane ga razgrađivati. Ali kada se dijete rodi, ono, naravno, isključivo jede majčino mlijeko. I u ovom slučaju, neasimilacija mlijeka polako dovodi do činjenice da se počinju razvijati razne patologije - osobito gastrointestinalni problemi, ciroza jetre, katarakta. Sve se to događa doslovno tijekom prvih tjedana i, nažalost, vrlo često dovodi do smrti. U međuvremenu, samo izbacivanjem mlijeka iz bebine prehrane, može se spriječiti da se ova urođena genetska bolest manifestira. Isto je i s fenilketonurijom, bolešću koja je uključena u prenatalni probir u Rusiji. Enzim odgovoran za metabolizam aminokiseline fenilalanin prestaje raditi kada mutira. Ali ako iz hrane izbacite namirnice koje sadrže upravo ovaj fenilalanin (uključujući neke orašaste plodove, gljive, neke mliječne proizvode), dijete će se razvijati zdravo. No, takvih priča o dijetama ima vrlo malo, možete ih nabrojati na prste. Znanstvenici pokušavaju pokupiti hranu za svakog pacijenta kako bi nekako olakšali njegovo postojanje. Ali svaka je bolest drugačija, a mutacije ne uzrokuju uvijek kvar i prestanak rada gena. Ponekad je funkcija proteina djelomično poremećena i ne radi tako učinkovito, pa je dovoljno negdje nešto malo nadoknaditi - i učinak je značajan.
Vjerojatno će biti proizvedeno u Kini - ako već nije napravljeno iza kulisa, o čemu također svi raspravljaju - "uređena" osoba.
Općenito, metode liječenja nasljednih bolesti mogu se podijeliti u dvije skupine. Prvi je zbog spojeva niske molekularne težine, kada možete odabrati neku vrstu tablete koja će nadoknaditi postojeće kvarove. Unatoč tome što smo svi navikli piti tablete, u slučaju nasljednih bolesti to vrlo rijetko djeluje. Ali ono što bi uvijek trebalo funkcionirati čisto teoretski - au slučaju genetskih kvarova na prvom mjestu - je korištenje različitih molekularnih metoda, kamo sada kreće sva medicinska genetika. Najzanimljivije je da za korištenje svih ovih pristupa postoji cijeli arsenal različitih opcija. Postoje metode koje vam omogućuju da aktivirate rad nekih specifičnih gena: gen ne radi, a mi ga možemo natjerati da aktivno radi u ovoj stanici. Ili, naprotiv, mutirani gen radi, proizvodi otrovne produkte, ali postoje pristupi koji mogu selektivno potisnuti njegov rad, tako da on, u cijeloj raznolikosti gena, prestane raditi.
Najnovija i zanimljiva stvar koja se rodila u genetici prije samo pet godina je uređivanje mutirane kopije gena. Pristupi koji vam omogućuju ispravljanje mutacije. Pričat ću o tome i kamo sve to vodi, ali prvo ću vas podsjetiti na postulat koji svi, u teoriji, znamo - središnju dogmu molekularne biologije. Sjećate se, govorio sam o velikom znanstveniku Jamesu Watsonu? Dakle, imao je prijatelja - Francisa Cricka, s kojim su zajedno otkrili dvolančanu strukturu DNK. Tada je Watson počeo raditi neke stvari, a Crick - druge (iako su obojica radili na polju molekularne biologije). Ali na ovaj ili onaj način, Crick je bio taj koji je formirao ovu središnju dogmu na temelju strukture molekule DNK: imamo DNK, iz nje se dobiva RNK, iz nje se dobiva protein, što je kruna cijele ove priče, koja onda nekako funkcionira, obavlja neke funkcije . Do danas je opisana ogromna raznolikost proteina, kako su raspoređeni, koje dijelove imaju koji su odgovorni za njihovo funkcioniranje. Zašto se ovo opisuje? Da bi se potom izgradila tako golema mreža gena.
Razumijemo koji su procesi povezani s kojim genima, kako se ti procesi pokreću, kako se signali prenose s jednog mjesta na drugo, kako se reguliraju. Razumijemo kako primijeniti sve ove pristupe da isključimo neki gen i uključimo ga. Odnosno, ako dođe do mutacije u genu, to ne znači da sve, na kraju, ne možemo ništa učiniti. Ne, mi možemo smisliti koju premosnicu aktivirati kako bismo uspostavili normalno postojanje stanica, normalan metabolizam. Ili – naprotiv – koji put suzbiti. A fundamentalna znanost je tu prijeko potrebna kako bi se ta znanja mogla dalje koristiti u genetici za liječenje nasljednih bolesti. Ali zašto je tako teško primijeniti te pristupe? Jer čovjek je višestanični organizam. Onako kako me sada vidite su milijarde stanica, svaka ima svoj program i svatko se bavi nekom svojom funkcijom. Neke stanice u mozgu, druge u mišićima. A sve je to vrlo komplicirano, pa ako namjeravam intervenirati u neki proces, morat ću doći ne do cijelog organizma kao cjeline, nego do onih stanica koje provode određeni fenotip. Ako pacijent ima napadaje, onda je slaba signalizacija u neuronima i ne trebam ometati rad svih stanica, moram doći do moždanih stanica. U skladu s tim, ciljana isporuka najteži je zadatak s kojim se znanstvenici danas suočavaju. To se lako provodi kada postoji određeni organ, dobro izoliran, gdje se sve može bez problema isporučiti. Najjednostavniji primjer je oko. Tako je prirodno da je ovdje, tako dostupno, tako izolirano - i radite što god želite s njim. I već se mnogo toga radi s njim - uključujući i korištenje genske terapije, kada je moguće podesiti neke procese ili ih, obrnuto, potisnuti. Ali postoji još jedan dobro dostupan organ - koža. Čini se da je ovdje, ali - tamo je nemoguće isporučiti materijale, jer koža ima zaštitnu barijeru koja ne dopušta da bilo kakva glupost stigne tamo.
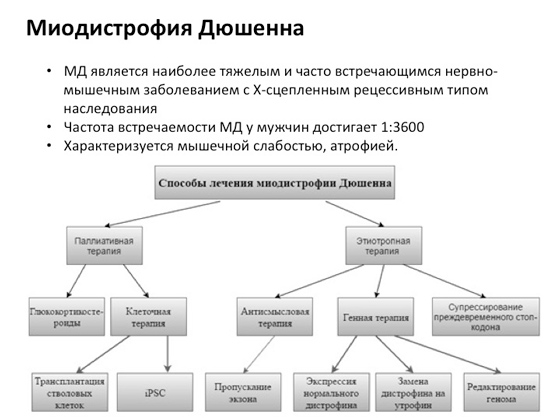
Postoji, na primjer, takva bolest - Duchenneova mišićna distrofija, koja je vrlo česta. Kako bi ga liječili, znanstvenici se razvijaju drugačija vrsta pristupa. I vidite, ne postoji jedan pristup na kojem su znanstvenici radili mnogo godina, već mnogo pristupa. Negdje se isprobava i stanična terapija - pacijentu se isporučuju nove stanice kako bi se shvatilo hoće li mu biti bolje ili ne. Ponegdje dodajte različite ljekovite spojeve. Nekima to ide bolje, nekima ne ide nikako. Jedna od najnovijih opcija: znanstvenici su razvili poseban Kemijska tvar, čime se izbjegavaju mutacije koje uzrokuju pojavu takozvanih stop kodona. Što je? U nekim slučajevima, mutacija dovodi do činjenice da ribosom, kada se kreće duž RNA i sintetizira protein, dolazi do zaustavnog kodona koji nastaje zbog mutacije, i kao rezultat toga, dobiva se skraćeni protein umjesto normalnog, jedan veliki. Skraćeni protein ne može normalno funkcionirati. I znanstvenici su došli do tvari koja pomaže ribosomu, kada se kreće duž molekule RNA, da prestane prepoznavati te zaustavne kodone, što rezultira dugim produktom. To je, zapravo, vrlo veliko postignuće - i dogodilo se nedavno.
No, usprkos svemu, glavna priča na koju svi računaju je genska terapija. Kada možemo nekako dostaviti kopiju gena koji ne nosi nikakve mutacije u stanicu s mutiranim genom. Za to postoji takozvana metoda virusne dostave. Odnosno, sami virusi od kojih obolijevamo modificiraju se na poseban način, uklanjaju se sve nepotrebne komponente, ostavlja samo strukturni dio i koristi se kao transport za isporuku normalnog ljudskog gena. Ova ideja je smišljena jako davno, a danas se istovremeno provodi u mnogim zemljama. Sada se diljem svijeta odvija nekoliko tisuća suđenja.
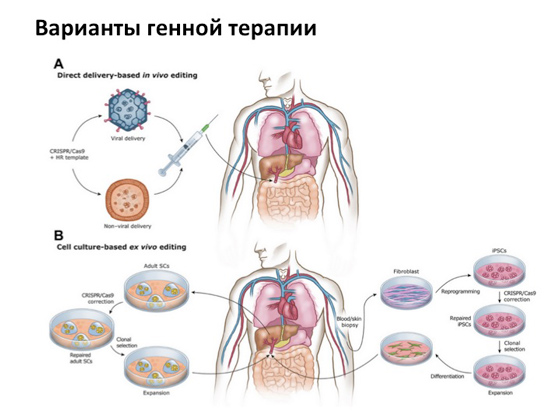
Na kraju ću vam ispričati nekoliko dobrih priča. Prvi je povezan s bolešću koja se naziva sindrom nedostatka adenozin deaminaze. Možda ste čuli za film "Bubble Boy" (ili ga čak gledali) - o tome kako je dječak živio i cijelo vrijeme bio u mjehuru, majka ga je štitila od svega, a on je pobjegao od kuće i vidio kako je lijepo svijet . Ova priča temelji se na stvarnim događajima. Dječak se zvao David Vetter, imao je upravo takvu genetsku bolest, povezanu, zapravo, s teškim oblikom imunodeficijencije. Grubo rečeno, dijete bi moglo umrijeti od bilo koje infekcije. A kada je postalo jasno da je tako teško bolestan, bio je prilično dugo izoliran od cijelog vanjskog svijeta u sobama u kojima je živio. Cijelo su ga vrijeme pokušavali liječiti različite metode, različite droge. Imao je sestru od koje mu je presađena koštana srž - ali ni to nije pomoglo. Priča je, općenito, tužna: dječak je umro ne doživjevši ni malo prije trenutka kada je genska terapija uspješno primijenjena u liječenju ove bolesti. To izgleda ovako: od pacijenta se uzimaju stanice koštane srži koje su odgovorne za proizvodnju imunoloških stanica, uz pomoć virusa im se dostavlja kopija gena, a zatim se stanice vraćaju pacijentu. Kao rezultat toga, osoba dobiva novu, da tako kažemo, koštanu srž s kopijom normalnog gena. Ova priča je prvi put realizirana 1990. godine.
Druga je priča o Leberovoj kongenitalnoj amaurozi - to je degeneracija mrežnice, koja je vrlo rijetka i nastaje zbog mutacije specifičnog gena koji kodira protein koji je odgovoran za pigmentni epitel mrežnice. Razvijene su posebne virusne čestice u kojima je bila normalna kopija gena RPE65, a pacijentima koji su bolovali od ove bolesti davale su se injekcije lijeka direktno u oko. Zbog toga se pacijentima koji su izgubili vid ili ga čak nisu imali od rođenja, tijekom liječenja vratio. Prošle je godine ovaj genski lijek odobrilo posebno povjerenstvo FDA, i trebao bi uskoro biti pušten u masovnu upotrebu.
Mnogo je takvih priča, ali kao što se sjećate, nasljednih bolesti ima jako puno, oko osam tisuća.
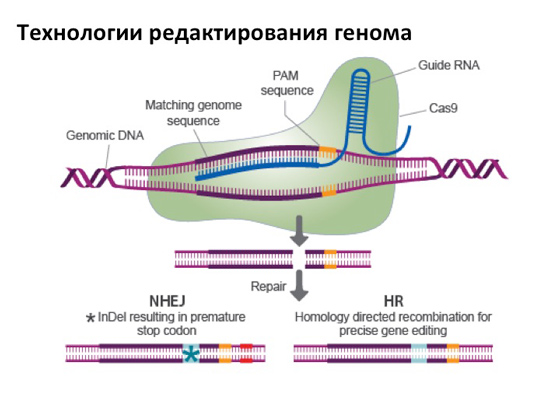
Na kraju, naravno, stvarno želim reći barem nekoliko riječi o tako divnoj tehnologiji kao što je uređivanje genoma. Napravila je potpunu senzaciju u znanosti. Suština ovog uređivanja je sljedeća: postoji određena vrsta proteina koja ima aktivnost nukleaze, odnosno može cijepati DNK, a zahvaljujući jednoj lukavoj RNK, možemo programirati protein da radi tako da razbija DNK u posebno mjesto. A onda postoje dvije opcije. Jedan od njih je sada važan za nas: kada protein razbije DNA na unaprijed planiranom mjestu koje sadrži mutaciju, mogu se aktivirati mehanizmi staničnih popravka, omogućujući popravak prekida tako da se pojavi nova kopija gena koja neće nositi mutaciju. A stvaranje ove vrste proteina koji se mogu specifično usmjeriti negdje, na neke specifične gene, vrlo je važan korak. I u isto vrijeme, vrlo jednostavna i praktična metoda: svaki student u dobro opremljenom laboratoriju može se nositi s tim za nekoliko mjeseci. Stoga se sada objavljuju mnoge publikacije o tome gdje i kada se ova tehnologija koristi, a jasno je da se njome prije svega pokušavaju liječiti razne genetske bolesti. I zasad, sudeći po znanstvenim člancima, sve ide dobro. Nedavno sam pročitao članak u jednom časopisu Priroda, koji je analizirao kako različite zemlje do danas su uređeni zakonodavni akti i gdje bi se prvi put trebala pojaviti "uređena" osoba - nije važno, sa supermoćima ili jednostavno izliječena od neke vrste bolesti. Ne ulazeći u detalje, apsolutno sve zemlje to ne podržavaju. Ali pitanje je koliko je duboko to navedeno na zakonodavnoj razini. Općenito, u članku se kaže da je jedna od potencijalnih zemalja u kojoj su sve te točke manje jasno navedene Kina. Štoviše, ako se ranije smatralo da je Kina znanstveno zaostala zemlja, sada su nas prestigli da ih se više ne može prestići, pogotovo u biologiji. Kinezi ulažu u ovaj ogroman novac. Privlače stručnjake iz cijelog svijeta, šalju svoje na proučavanje, a zatim ih vraćaju i daju im laboratorije i institute. Vrlo su aktivni u tom smjeru. Vjerojatno će u Kini biti napravljena "uređena" osoba - ako već nije napravljena iza kulisa, o čemu također svi raspravljaju. I već prva priča, koja se dugo nije mogla objaviti, govorila je o tome da su već demonstrirali metodu za uređivanje genoma na ljudskim embrijima. Tu nije bilo ništa strašno, sve je napravljeno jako dobro i korektno, ljudski embriji se nisu mogli dalje razmnožavati i uzeti su kao modelni objekt. Općenito, eksperiment je pokazao da tijekom uređivanja postoji mnogo pogrešaka. Kao što je uobičajeno u znanstvenoj zajednici, svaka vijest ove vrste aktivno se raspravlja: s jedne strane, svi razumiju da da, sve ove tehnologije koje su se upravo pojavile prikladne su za rješavanje raznih problema. Na drugoj strani, nuspojave koje se mogu pojaviti, nitko ne može predvidjeti. I zato znanstvenici vrlo pažljivo, korak po korak, pokušavaju sve to provjeriti i istražiti. Ne volim vam davati nadu, ali čini mi se da ćemo u sljedećih deset do dvadeset godina sigurno imati pouzdane načine liječenja genskom terapijom. Za sada imamo to što imamo.
Objavila Natalya Kostrova
Genetičar obavlja dvije glavne funkcije. Prvo, on "pomaže" svojim kolegama u "dijagnosticiranju", koristeći posebne genetske metode u diferencijalnoj dijagnozi, i, drugo, on određuje "prognozu zdravlja budućeg potomstva" (ili već rođenog). Pritom se pred liječnikom uvijek pojavljuju medicinski, genetski i deontološki problemi; u različitim fazama savjetovanja prevladava jedno ili drugo.
Medicinsko genetsko savjetovanje sastoji se od 4 faze; dijagnoza, prognoza, zaključak, savjet. Pritom je neophodna iskrena i prijateljska komunikacija između genetičara i obitelji bolesnika.
Savjetovanje uvijek započinje pojašnjenjem dijagnoze nasljedne bolesti, jer je točna dijagnoza neophodan preduvjet svake konzultacije. Nadležni liječnik, prije upućivanja bolesnika na medicinsko genetsko savjetovanje, treba, koristeći metode koje su mu dostupne, razjasniti dijagnozu koliko je to moguće i odrediti svrhu konzultacija.
Također je potrebno koristiti genealoške, citogenetičke, biokemijske i druge posebne genetičke metode (primjerice, utvrditi povezanost gena ili koristiti molekularno genetičke metode i sl.). U takvim slučajevima pacijent se upućuje na medicinsku genetičku konzultaciju, a genetičar pomaže liječniku u postavljanju dijagnoze. U tom slučaju, možda će biti potrebno uputiti pacijenta ili njegovu rodbinu na dodatne studije.
Genetičar postavlja druge liječnike (neurologa, endokrinologa, ortopeda, oftalmologa itd.) s određenim zadatkom - prepoznati simptome sumnje na nasljednu bolest kod pacijenta ili njegovih srodnika. Sam genetičar ne može biti toliko "univerzalan" liječnik da u potpunosti poznaje kliničku dijagnozu nekoliko tisuća nasljednih bolesti. U prvoj fazi savjetovanja genetičar se suočava s brojnim čisto genetskim zadaćama (genetska heterogenost bolesti, nasljedna ili novonastala mutacija, okolišna ili genetska uvjetovanost pojedine prirođene bolesti itd.), za koje se priprema u procesu specijalizacija. Pojašnjenje dijagnoze u medicinsko-genetičkoj konzultaciji provodi se genetskom analizom, koja razlikuje genetičara od drugih stručnjaka. U tu svrhu genetičar se koristi genealoškim, citogenetskim i molekularno genetski metode, kao i analiza povezanosti gena, metode genetike somatskih stanica. Od negenetskih metoda uvelike se koriste biokemijske, imunološke i druge parakliničke metode koje pomažu u postavljanju točne dijagnoze. „Genealoška metoda“, pod uvjetom pažljivog prikupljanja rodovnice, daje određene podatke za dijagnozu nasljedne bolesti. U slučajevima kada je riječ o još nepoznatim oblicima, genealoška metoda omogućuje opis novog oblika bolesti. Ako je vrsta nasljeđivanja jasno označena u rodovnici, tada je savjetovanje moguće čak i s neodređenom dijagnozom. (O značajkama korištenja kliničke genealoške metode i njezinim mogućnostima rješavanja raspravljalo se gore.) U medicinskom genetičkom savjetovanju ova se metoda koristi u svim slučajevima bez iznimke. „Citogenetska studija“, kako svjedoče iskustva brojnih konzultacija, koristi se u najmanje 10% konzultacija. To je zbog potrebe prognoze za potomstvo s utvrđenom dijagnozom kromosomske bolesti i pojašnjenja dijagnoze u nejasnim slučajevima s urođene mane razvoj. Svi ovi problemi često se susreću u praksi savjetovanja. U pravilu se ne ispituju samo probandi, već i roditelji.
Biokemijske, imunološke i druge parakliničke metode nisu specifične za genetsko savjetovanje, već se koriste jednako široko kao u dijagnostici nenasljednih bolesti. Kod nasljednih bolesti često postaje potrebno primijeniti iste testove ne samo na bolesnika, već i na ostale članove obitelji (sastavljanje biokemijskog ili imunološkog "pedigrea"). U procesu genetskog savjetovanja često se javljaju nove potrebe za dodatnim parakliničkim pretragama. U takvim slučajevima bolesnik ili njegovi srodnici šalju se u odgovarajuće specijalizirane ustanove. U konačnici, dijagnoza u medicinskom genetičkom savjetovanju pojašnjava se genetskom analizom svih primljenih informacija, uključujući (ako je potrebno) analizu podataka o povezivanju gena ili rezultate proučavanja uzgojenih stanica. Za provođenje genetske analize potrebno je da genetičar bude visokokvalificirani stručnjak iz područja medicinske genetike. Nakon razjašnjenja dijagnoze utvrđuje se "prognoza za potomstvo". Genetičar formulira genetski problem čije se rješenje temelji ili na teoretskim izračunima pomoću metoda genetske analize i statistike varijacije ili na empirijskim podacima (empirijske tablice rizika). Iz ovoga je jasno da uobičajena medicinska izobrazba liječnika opće prakse ne dopušta mu da kompetentno napravi takvu prognozu. Pogreška liječnika s pogrešnom prognozom za obitelj može biti kobna: teško bolesno dijete može se ponovno roditi. U slučajevima kada se koristi prenatalna dijagnoza, otklanja se potreba za rješavanjem genetskog problema. U takvim slučajevima se ne predviđa rođenje djeteta s bolešću, već se bolest dijagnosticira u fetusu. „Zaključak medicinsko genetskog savjetovališta i savjeta roditeljima“ jer se posljednje dvije faze mogu kombinirati.
Pisano mišljenje liječnika genetičara obvezno je za obitelj, kako bi se članovi obitelji mogli vratiti razmišljanju o situaciji. Uz to, potrebno je na pristupačan način usmeno objasniti značenje genetskog rizika i pomoći obitelji u donošenju odluke. Završne faze savjetovanja zahtijevaju najveću pozornost. Koliko god se usavršavale metode izračuna rizika (empirijski ili teorijski), koliko god se u potpunosti u rad ordinacija uvode dostignuća medicinske genetike, nemoguće je postići željeni učinak savjetovanja ako pacijenti pogrešno razumiju objašnjenje genetičar. Ovdje može pomoći i kontakt s liječnikom obiteljske medicine u kojeg supružnici imaju posebno povjerenje, pa je vrlo važna koordinacija djelovanja obiteljskog (lečećeg) liječnika i genetičara. Da bi se postigao cilj konzultacije, u razgovoru s pacijentima treba voditi računa o stupnju njihove naobrazbe, socioekonomskom položaju obitelji, strukturi ličnosti i odnosu supružnika. Mnogi pacijenti nisu spremni percipirati informacije o nasljednim bolestima i genetskim obrascima. Jedni su skloni osjećati krivnju za nesreću koja se dogodila i pate od kompleksa manje vrijednosti, drugi sasvim ozbiljno vjeruju prognozama temeljenim na "pričama poznanika", treći dolaze na konzultacije s nerealnim zahtjevima ili očekivanjima zbog činjenice da su bili pogrešno svjesni o mogućnostima genetskog savjetovanja (ponekad uključujući i liječnike). Treba imati na umu da gotovo svi supružnici savjetovališta žele imati dijete (inače ne bi tražili savjet). Time se znatno povećava profesionalna odgovornost i liječnika i genetičara. Svaka netočna riječ može se protumačiti u "smjeru" u kojem su supružnici postavljeni. Ako se supružnici jako boje bolesnog djeteta i, naravno, žele imati zdravo dijete, onda svaka nemarna fraza liječnika o opasnosti povećava taj strah, iako u stvarnosti rizik može biti mali. Ponekad je, naprotiv, želja za djetetom toliko jaka da čak i pod visokim rizikom supružnici odluče imati djecu, jer je liječnik rekao o nekoj vjerojatnosti rođenja zdravo dijete. Način tumačenja rizika mora se prilagoditi svakom slučaju pojedinačno. U nekim slučajevima, trebali bismo govoriti o 25% šanse da imamo bolesno dijete, u drugima - o 75% šanse da imamo zdravo dijete. Međutim, uvijek je potrebno uvjeriti bolesnike u slučajnu raspodjelu nasljednih čimbenika kako bi se oslobodile vlastite krivnje za rođenje bolesnog djeteta. Ponekad je taj osjećaj vrlo jak. Preporučljivo je poslati supružnike na medicinsko genetsko savjetovanje ne prije 3 mjeseca nakon dijagnoze nasljedne bolesti, budući da se tijekom tog razdoblja odvija prilagodba situaciji koja je nastala u obitelji, a ranije se loše percipiraju sve informacije o budućoj djeci. . Taktika genetičara u pomaganju pacijentima u donošenju odluka nije konačno određena. Naravno, ovisi o konkretnoj situaciji. Iako odluku donose sami pacijenti, ponašanje liječnika može biti različito: 1) uloga liječnika u donošenju obiteljskih odluka može biti aktivna; 2) uloga liječnika treba se svesti samo na objašnjavanje značenja rizika. U donošenju odluke savjetom bi, po našem mišljenju, trebali pomoći genetičar i ordinirajući liječnik (osobito obiteljski liječnik), budući da uz postojeću razinu znanja iz područja genetike u populaciji, konzultantima je teško donijeti odluku. vlastitu adekvatnu odluku. Medicinske zadaće savjetovanja lakše je riješiti nego društvene i etičke probleme. Na primjer, nema sumnje da je teže nasljedna bolest, hitnije bi liječnik trebao preporučiti odbijanje rađanja. Ali kod iste bolesti, uz istu vjerojatnost da će se dijete roditi, različite situacije u obitelji (sigurnost, odnosi među supružnicima i sl.) zahtijevaju različite pristupe objašnjenju rizika. U svakom slučaju, odluka o rađanju djece ostaje na obitelji. 10.3.3. Organizacijska pitanja Prilikom organiziranja medicinsko-genetičkih konzultacija kao strukturnih podjedinica, potrebno je osloniti se na zdravstveni sustav koji se razvio u zemlji i uzeti u obzir stupanj razvoja medicine općenito, uključujući i razinu poznavanja genetike od strane liječnika. Konzultacije funkcioniraju kao sastavna karika u postojećem sustavu medicinska pomoć populacija. U većini stranih zemalja s razvijenim zdravstvenim sustavom savjetovalište je trostupanjsko: 1) prognozu za potomstvo u jednostavnim slučajevima utvrđuje obiteljski liječnik; 2) složeniji slučajevi "dolaze" do genetičara koji rade u velikom medicinskom centru; 3) savjetovanje u složenim genetskim situacijama provodi se u posebnim genetskim konzultacijama. Za provedbu ovog općenito učinkovitog sustava potrebno je, s jedne strane, da svaki obiteljski ili ordinirajući liječnik dobro razumije kliničku genetiku, as druge strane, razina organizacije medicinske skrbi za stanovništvo mora biti visoka. . Mediko-genetske konzultacije kao ustrojstvene jedinice zdravstvenih ustanova mogu biti opće i specijalizirane.
Analiza kontingenta onih koji se prijavljuju za "opću konzultaciju" prema "nozološkom principu" pokazuje da probandi imaju široku paletu patologija. Budući da rad na razjašnjavanju dijagnoze u konzilijumu ima velik udio, raznolik profil bolesti probandala uvjetuje da se u preglede kod različitih specijalista uključe i probandi i srodnici. U tom smislu, najprikladnije je stvoriti genetske konzultacije na temelju velikih multidisciplinarnih medicinskih ustanova republičke ili regionalne podređenosti. Pacijent i njegovi rođaci u ovom slučaju imaju priliku dobiti savjet od stručnjaka i, ako je potrebno, moći će biti hospitalizirani. Osim toga, konzultacija bi trebala biti u mogućnosti poslati na specijalizirani (tomografija, hormonski profil, itd.) Pregled u druge ustanove, ako bolnica na temelju koje konzultacija djeluje nema takve mogućnosti. Bliski kontakt s drugim odjelima i njihova pravilna subordinacija su važno načelo rad medicinske genetske konzultacije općeg profila. U velikim specijaliziranim bolnicama mogu se organizirati "specijalizirane medicinsko-genetske konzultacije" u kojima genetičar stječe iskustvo u savjetovanju o nasljednim bolestima jednog profila. U teškim slučajevima, pacijente treba uputiti iz opće konzultacije u specijaliziranu konzultaciju. Dvije konzultacije - opće i specijalizirane - mogu funkcionirati paralelno, a da se međusobno ne zamjenjuju i da nisu podređene. Osoblje opće konzultacije treba uključivati genetičare, citogenetičare i genetičare biokemičare. Genetičar koji provodi prijem stanovništva mora imati sveobuhvatnu genetičku izobrazbu, budući da mora rješavati široku paletu genetskih problema. Specifičnost rada genetičara je u tome što je objekt njegovog istraživanja obitelj, a proband je samo "početna" osoba u ovom istraživanju, pa otuda i specifični oblici rada. Svaka konzultacija zahtijeva prikupljanje informacija o rođacima, a ponekad i njihov pregled. Zaključak genetičara o ponovnoj opasnosti od bolesti namijenjen je izravno obitelji koja se obratila za pomoć, pa se značenje zaključka mora objasniti u pristupačnom obliku (često više članova obitelji). Sve to oduzima puno više vremena nego prijem pacijenta kod bilo kojeg drugog stručnjaka. Za početni pregled probanda i njegovih roditelja, kao i za prikupljanje obiteljske anamneze potrebno je 11/2 - 2 sata. Ponovljena konzultacija (pisano mišljenje, objašnjenje u pristupačnom obliku, pomoć pri donošenju odluke) traje u prosjeku 30 minuta. Dakle, jedan genetičar tijekom radnog dana može pregledati najviše 5 obitelji. Od svih specijalnih studija najveća potreba javlja se za citogenetskim analizama. Velika potreba za primjenom citogenetičke metode uvjetovana je upućivanjem u medicinsko genetičko savjetovalište, prije svega, bolesnika s kromosomskom patologijom, prirođenim malformacijama i opstetrička patologija. U ovom slučaju, u pravilu, ne ispituje se jedna osoba, već dvije ili tri. Potreba za biokemijskim studijama je oko 10%, tj. za svaku 10. obitelj koja se prijavila na konzultacije. Ovo je prilično visok broj. Međutim, kod velikog broja nasljednih metaboličkih bolesti ponovna primjena istih biokemijskih metoda u konzultacijama bit će vrlo rijetka. Stoga je u velikim gradovima najsvrsishodnije osnivati specijalizirane biokemijske laboratorije s velikim metodološkim mogućnostima za ispitivanje bolesnika s različitim metaboličkim poremećajima. U samoj medicinsko-genetičkoj konzultaciji provodi se "screening dijagnostika" (takve metode su "prilagođene" širokoj praksi) bez faze razjašnjavanja, koja je gore spomenuta. Dakle, genetsko savjetovalište kao ustrojstvena jedinica manji je dio polikliničke službe, a sastoji se od genetičke ordinacije, proceduralne sobe (vađenje krvi) i laboratorija za citogenetske i probirne biokemijske studije; Kliničke, parakliničke, molekularno genetičke, biokemijske, imunološke i druge studije provode se u specijaliziranim laboratorijima i medicinskim ustanovama, uz koje se veže konzultacija. Prisutnost takvih konzultacija u bolnicama ne isključuje organizaciju visoko specijaliziranih medicinskih genetskih centara sa svim potrebnim odjelima.
Najveće perspektive u znanosti sada se otvaraju na raskrižju znanstvenih disciplina. Očito: niti jedan fizičar, astronom ili kemičar ne može bez matematike. Međudjelovanje atoma i molekula može se promatrati i s fizičkog i s kemijskog gledišta.
Što je ekologija, a što genetika, otprilike je svima jasno. Genetski aparat čovjeka, kao i ostalih stanovnika Zemlje, pod utjecajem je različitih čimbenika okoliša. Štoviše, ljudi se smatraju jednom od najosjetljivijih vrsta na takve utjecaje.
Utjecaj na nasljeđe ionizirajućeg zračenja je genetika zračenja.
Genotoksikologijaproučava promjene u genima pod utjecajem kemikalija.
Organizmi i vrste međusobno djeluju, što ne prolazi bez traga za njihov genetski aparat – međutim, kao i za samu ekološku genetiku; njegov odgovarajući odjeljak naziva se pomalo nezgrapan: genetika interorganizmskih i interspecijskih interakcija.
Unutar njega postoji čak i tako zanimljiva stvar kao što je simbiogenetika - genetika interakcije vrsta koje žive u simbiozi.
Utjecaj Černobila i droge
Genetičar okoliša bavi se ne samo temeljnim istraživanjima u istraživačkim institutima - on će također naći primjenu u specifičnoj praksi. Ima se na čemu raditi. Ove godine obilježava se 20. obljetnica nezaboravne nesreće u nuklearnoj elektrani Černobil, a razmjeri uporabe radioaktivnih tvari sada su doista veliki. Osim toga, lijekovi i druge nove tvari, bilo da su dobivene iz prirodnih izvora ili umjetno sintetizirane, također moraju biti testirane na mutagenost. A kako bi se riješila brojna pitanja moderne ekologije, potrebni su kvalificirani stručnjaci koji posjeduju i genetske metode i znanje o interakciji organizama s okolišem na različitim razinama.
Radeći u bilo kojem od ovih područja, bavi se profesionalac testiranje specifične čimbenike okoliša - odnosno utvrđuje kako taj čimbenik iu kojoj dozi djeluje na živi organizam, njegove kromosome i gene u njima. Ili provodi ispitivanje - otkrivajući utjecaj ovog određenog faktora u ovoj određenoj dozi u ovom konkretnom slučaju.
Dakle, što rade s miševima?
 Testovi nisu samo psihološki - već i toksikološki. Toksikološki genetičari identificiraju mutagene (kada geni mutiraju ili se kromosomska DNK lomi) i kancerogene učinke razne tvari. U tu svrhu postoje razni testovi i testni sustavi. U slučaju kada je potrebno brzo napraviti početnu procjenu djelovanja tvari na organizam i njegov genom (odnosno na ukupnost nasljednih svojstava), koriste se kratkotrajni testovi. Naravno, oni nisu tako pouzdani kao dugoročni testovi, čiji su nedostaci visoki troškovi testiranja i, po definiciji, trajanje. Stoga se najčešće koriste testovi na sredini semestra.
Testovi nisu samo psihološki - već i toksikološki. Toksikološki genetičari identificiraju mutagene (kada geni mutiraju ili se kromosomska DNK lomi) i kancerogene učinke razne tvari. U tu svrhu postoje razni testovi i testni sustavi. U slučaju kada je potrebno brzo napraviti početnu procjenu djelovanja tvari na organizam i njegov genom (odnosno na ukupnost nasljednih svojstava), koriste se kratkotrajni testovi. Naravno, oni nisu tako pouzdani kao dugoročni testovi, čiji su nedostaci visoki troškovi testiranja i, po definiciji, trajanje. Stoga se najčešće koriste testovi na sredini semestra.
Osim toga, obično se ne provodi jedan test, već niz od tri ili više različitih testova, uz korištenje različitih modela objekata, kao što su miševi. Ovisno o dobivenim rezultatima donosi se zaključak o štetnosti ili relativnoj sigurnosti ispitivane tvari. Kontrolnu skupinu, naravno, čine isti "objekti", ali bez utjecaja ispitivane tvari. Pokazatelj štete obično je opstanak modela objekata.
Tijekom ispitivanja izračunava se i učestalost pojave malignih tumora i mutacija kod pokusnih životinja. Nažalost, svaki eksperimentalni biolog (a to su obično genetičari okoliša) mora se odmah pomiriti s ovom tužnom okolnošću: ona će pratiti njegov rad. Koliko god miševa, štakora ili žaba bilo žao, oni se moraju žrtvovati kako kasnije ne bismo postali žrtve. Posebno dojmljive čitatelje mogu samo utješiti činjenicom da je spomenik Žabi podignut u Lvovu, spomenik Mački na Državnom sveučilištu u Sankt Peterburgu, a spomenik Psu na Znanstvenom institutu za eksperimentalnu medicinu (Petersburg). .
Koja se konkretna testiranja provode, od kojih zadataka se sastoje radni dani? Iz dana u dan provodi toksikolog-genetičar rutinska metafazna analiza- označava kromosome posebnom bojom, nakon čega se sami kromosomi i, sukladno tome, mnogi njihovi preraspodjeli (to je predmet proučavanja) mogu promatrati pod mikroskopom. Pod nadzorom znanstvenika su također mikronukleus testovi(kada se stanica dijeli, abnormalni kromosomi koji signaliziraju bolest često odlaze u tzv. “mikronukleus”, koji je mnogo manji od normalne stanične jezgre; pod određenim uvjetima i bojanjem bojama, te se mikronukleuse mogu uočiti na preparatima). Ima li još anatelofazni test; temelji se na činjenici da neke anomalije kromosoma sprječavaju njihovo pravilno i pravovremeno raspršivanje u nove jezgre tijekom stanične diobe, stoga se u kasnijim fazama diobe mogu uočiti karakteristična odstupanja diobe - na primjer, skakači ili zaostajanja.
Ako je ispitivana tvar barem u jednom od testova pokazala smanjenu stopu preživljavanja, povećan rizik od mutacije ili pojavu malignih tumora, već se smatra nesigurnom.
Pogledaj kroz mikroskop - i reci mi je li bilo zračenja
genetika zračenja bave se proučavanjem utjecaja na genom ionizirajućeg zračenja – odnosno zračenja s dovoljno visokom energijom da izazove ionizaciju molekula. Upamtite da se DNK sastoji od dva lanca, vezan prijatelj sa prijateljem? Dio jednog takvog lanca može se sintetizirati umjetno. Zatim ovaj tzv sonda potrebno je na poseban način označiti, a potom “hibridizirati” s postojećim preparatom krvnih limfocita. Naša sonda će se "vezati" na željeni gen ili regiju kromosoma, kao da je dio "nativnog" drugog lanca DNK, a ta se regija može vidjeti zahvaljujući oznaci. Na taj način će biti moguće pratiti kromosomske preraspodjele specifične za zračenje. Budući da se ova studija provodi na razini stanice, ova metoda - zove se
in situ hibridizacija- odnosi se na citogenetski. Međutim, svi navedeni testovi su također citogenetski. Istraživanja se provode i na drugoj razini – na razini molekula.
Ali u svakom slučaju, znanstvenici gledaju kako se kromosomi ponašaju. Na primjer, jeste li znali da pojava u stanici kromosoma s dvije centromere (obično suženje koje povezuje "ramena" kromosoma, ili centromera, mora biti jedan) gotovo sigurno ukazuje na izloženost? Spontano su takvi kromosomi izuzetno rijetki. Stoga takozvani dicentrični kromosom služi kao svojevrsni signal za uzbunu za osobe koje se bave dijagnostikom zračenja. Smatra se da se prema broju istih dicentričnih kromosoma može približno odrediti primljena doza zračenja. Na tome se temelji biodozimetrija.
Genetika privlačnosti
 Genetika međuorganizmskih interakcija, simbiogenetika istražuje interakciju genoma različitih organizama i njihovih vrsta.
Genetika međuorganizmskih interakcija, simbiogenetika istražuje interakciju genoma različitih organizama i njihovih vrsta.
Postoji nekoliko prikladnih modela za takve studije. Jedan od najpristupačnijih je sustav interakcije kvasca ( Sacharmyces cerevisia) i vinska mušica. Drosophila melanogaster. Muha treba steroidne hormone za normalan razvoj i sposobnost da ostavi potomstvo – ali ih sama ne proizvodi. Pronašla je izlaz zahvaljujući kvascu. Muha ih konzumira zajedno sa steroidima koje sintetiziraju! Genotip kvasca utječe na muhe - određene "obitelji" kvasca, karakterizirane strogo određenim skupom gena, muhe "vole" više od drugih, učinkovitije su, a neke čak mogu biti štetne za muhe.
Osim muhe s kvascem, proučava se i genetika interakcije kvržičnih bakterija s leguminoznim biljkama (bakterije uzrokuju nastanak tumora na njihovom korijenu, pa su možda neke spoznaje na tom području primjenjive i u onkologiji - ovako ili onako, a zahvaljujući njima već je pronađen novi način genetske modifikacije biljaka); endo- i egzomikoriza; lišajevi (genetski zanimljiva bliska kombinacija gljiva i algi u jedan organizam). Ovdje ima još mnogo toga za istražiti i razjasniti.
Osim toga, postoji još jedan interes Pitaj. Kako se sve više zna, feromoni su uključeni u odabir bračnih partnera. Čak i kvasac izlučuje feromonalne tvari - i tako se dvije stanice kvasca s različitim takozvanim "tipovima parenja" (slično spolu kod razvijenijih bića) nalaze jedna drugu kako bi nastavile svoj životni ciklus. U višim organizmima, također uključen imunološki sustav. Što se više različitih skupova posebnih molekula (tzv. glavni histonski inkompatibilni kompleks) razlikuju kod različitih pojedinaca, to su oni jedni drugima privlačniji. Ovo je još jedna tema za istraživanje genetike interorganizmskih interakcija.
Gdje i kako učiti
Student može studirati genetiku okoliša na biološkim fakultetima, odjelima za genetiku (ili čak konkretno - genetiku okoliša) različitih sveučilišta. To mogu biti pojedinačne specijalizacije ili magistarski programi ili samo teme teze maturanti.
Uz izravno specijalizirane, među proučavanim disciplinama - genetski mehanizmi prilagodbe, mehanizmi modifikacijske varijabilnosti(onaj koji nije uzrokovan niti genima niti njihovim mutacijama i javlja se tijekom života organizma, ovisno o njegovim uvjetima), okolišni geni i ljudsko nasljeđe i drugi. Postoje dodatni tečajevi citogenetika populacijska genetika,imunogenetika,genetika starenja i druge jednako zanimljive teme.
Na praktikumima se uči raditi s modelnim objektima, pravilno planirati i postavljati eksperimente (odnosno u skladu sa postavljenim ciljem), dobivati rezultate i analizirati podatke dobivene metodama matematičke statistike.
I genetika, i ekologija – a može li se i bez kruha?
 Danas nije lako biti biolog. Nije tajna da se znanosti u našoj zemlji posvećuje vrlo malo financijske pažnje. Međutim, genetika je u tom smislu imala sreće. Pozivamo vas da podržite entuzijazam mladih genetičara veliki broj razni programi stipendiranja, natjecanja, stipendije - ruski i zajednički sa stranim kolegama. Konkretno, jedan od najpopularnijih domaćih financijskih programa su potpore Ruske zaklade za temeljna istraživanja (RFBR). Inače, sredstva se mogu dodjeljivati kako za temeljne projekte laboratorija općenito, tako i za istraživačke projekte pojedinih mladih znanstvenika, ovisno o konkretnim programima i uvjetima natječaja.
Danas nije lako biti biolog. Nije tajna da se znanosti u našoj zemlji posvećuje vrlo malo financijske pažnje. Međutim, genetika je u tom smislu imala sreće. Pozivamo vas da podržite entuzijazam mladih genetičara veliki broj razni programi stipendiranja, natjecanja, stipendije - ruski i zajednički sa stranim kolegama. Konkretno, jedan od najpopularnijih domaćih financijskih programa su potpore Ruske zaklade za temeljna istraživanja (RFBR). Inače, sredstva se mogu dodjeljivati kako za temeljne projekte laboratorija općenito, tako i za istraživačke projekte pojedinih mladih znanstvenika, ovisno o konkretnim programima i uvjetima natječaja.
Genetičar okoliša može se baviti ne temeljnom znanošću, već primijenjenim aktivnostima. Sve će ovisiti o tome gdje će raditi. Ako se testiranja i ispitivanja provode u javnim i privatnim tvrtkama i laboratorijima koji se ne bave znanošću kao takvom, privatne tvrtke mogu ponuditi prilično dobru zaradu. Međutim, broj takvih mjesta je ograničen. S druge strane, ako imate inicijalna sredstva, možete osnovati vlastitu tvrtku ili neovisni stručni laboratorij - možda udruživanjem napora, na primjer, s analitičarima-kemičarima.
Međutim, velika čast ekoloških genetičara koji žele raditi u svojoj specijalnosti i dalje ostaje u znanosti. Konstantno se održavaju brojne konferencije i škole za razmjenu informacija i uspostavljanje kontakata između mladih znanstvenika - odličan način za pronalaženje perspektive: na taj način možete naići na zanimljive teme i razvoj, naučite o praksi. Nedavno se redovito počela održavati škola o ekološkoj genetici, a organizatori ove škole bili su upravo aktivisti Odsjeka za genetiku i uzgoj Državnog sveučilišta St. Za radijacijske genetičare, Škola radijacijskih biologa održava se svake godine u Obninsku, vrlo zanimljiv i koristan događaj u organizaciji Obninskog medicinskog radiološkog istraživačkog centra.
Naravno, međunarodne konferencije predstavljaju nam posebnu perspektivu. Tako je nekoliko mojih poznanika ostvarilo korisne kontakte u raznim zemljama i dobilo poziv za rad u inozemstvu (npr. jedna djevojka sada radi u jednom od laboratorija u Njemačkoj). Tu su, primjerice, i zajednički rusko-njemački projekti radioloških istraživanja.
Korisni ljudi
Dakle, biti ili ne biti? A sada je na svakom pojedincu da odluči. U svoje osobno ime mogu vas uvjeriti da su ekološka genetika i svi njezini dijelovi koje sam opisao vrlo zanimljivi, iznimno korisni i vrlo obećavajući. Ne govorim o tome da, kao i svaka znanost, ekološka genetika proučava ono što je oko nas, samo u mnogo većoj mjeri. važan aspekt- aspekt izravnog utjecaja na nas. Na kraju krajeva, naš svijet je sve ono s čime dolazimo u kontakt i s čime komuniciramo svaki dan.
I na kraju, posadit ću sjeme nade u duše onih koji bi se htjeli baviti znanošću (osobito genetikom okoliša), ali ih još uvijek muči pitanje financijske perspektive. Nažalost, zbog niskih plaća u naše vrijeme u znanost idu samo zainteresirani entuzijasti. Malo je takvih. S druge strane, iz godine u godinu sve je više ekonomista, pravnika i predstavnika drugih prestižnih i vrlo dobro plaćenih zanimanja u našoj zemlji. Sve ovo - za sada ... Zamislite što će se dogoditi za 10-15 godina, kada mudri, poštovani, ali, nažalost, ne vječni starija generacijačak i oni sovjetski znanstvenici će otići na zasluženi odmor ... Znanstvenik će postati rijetka vrsta navedena u Crvenoj knjizi. Ali država itekako treba znanost. A kako bi privukli ljude u ovo područje, počet će (da, čini se da već počinje - plaća zaposlenika RAS-a povećana je 2 puta) poticati znanost u rublju. Biti znanstveni djelatnik postat će prestižno ne samo zbog javnog poštovanja umnog rada, već iu financijskom smislu.
Tko će zauzeti mjesto starije generacije znanstvenika? Vas. Dok "ekstra" pravnici i ekonomisti neće znati gdje bi sa sobom...
Recenzije, komentari i rasprave
Genetika je znanost o obrascima nasljeđivanja i varijacija. U naše vrijeme genetika igra jednu od najvažnijih važne uloge ne samo u medicini, već iu poljoprivredi.
Tko je genetičar?
Genetičar je liječnik specijalist koji se bavi dijagnostikom, liječenjem i prevencijom patoloških procesa uzrokovanih nasljednom sklonošću. Ljudi najčešće traže savjet genetičara u fazi planiranja djeteta ili ako se sumnja da osoba ima bilo koju nasljednu bolest.
U slučaju da je par u krvnom srodstvu i planira ili je već začeo dijete, savjetovanje i promatranje genetičara jednostavno je obavezno.
Što spada u kompetenciju genetike?
Sve bolesti koje mogu biti uzrokovane nasljednom predispozicijom ili uzrokovane bliskim srodničkim odnosom spadaju u nadležnost genetičara.
Osim toga, genetičar može izračunati stupanj rizika od razvoja određene bolesti kod djeteta, pod uvjetom da su oba roditelja ili jedan od njih nositelji. U ovom slučaju, liječnik nužno vodi razgovor s roditeljima, objašnjavajući im sve čimbenike, rizike i razvoj patološkog procesa u budućnosti.
Treba napomenuti da genetičar ne liječi niti jedan organ. Specijalist radi na identificiranju bolesti u cjelini, s obzirom na cijeli organizam.
Koje bolesti liječi genetičar?
U području nadležnosti ovog stručnjaka leži ogroman broj patoloških procesa. Neki od njih su izuzetno rijetki. Najčešće bolesti uključuju sljedeće:
- patologije koje imaju dominantan, recesivan X-vezan tip nasljeđivanja;
- genomika;
- sindromi različite vrste(, disomija, mačji krik);
- mentalna retardacija;
- genetska predispozicija bebe na alkoholizam, konzumiranje droga, nikotin;
- mutacije raznih vrsta.
Osim toga, genetičar može sastaviti rodovnicu i izračunati stupanj rizika od razvoja bilo koje genetske bolesti kod djeteta u fazi začeća.
Kada biste trebali posjetiti genetičara?
Konzultacije s ovim stručnjakom obavezne su u fazi planiranja djeteta, pod uvjetom da je u obitelji bilo slučajeva teških nasljednih patologija. Posebno treba obratiti pozornost na to ako je dijete već rođeno u obitelji, s bilo kojom genetskom bolešću ili s patologijom nepoznate etiologije.
Ipak, treba napomenuti da konzultacija s genetičarom neće biti suvišna čak i ako nema vidljivih razloga za zabrinutost. Uz pomoć suvremenih dijagnostičkih metoda, ozbiljna patologija može se otkriti već u fazi prvog tromjesečja trudnoće. Posjet genetičaru je obavezan ako je ultrazvuk otkrio odstupanje u razvoju fetusa.
Potrebno je uzeti u obzir činjenicu da se dijagnoza stručnjaka ne može uvijek smatrati rečenicom. Mnogi patološki procesi, čak i oni s nasljednom predispozicijom, mogu se korigirati ili svesti na minimum.
Također, treba kontaktirati genetiku ako su sljedeći čimbenici istiniti:
- žena rađa samo mrtvu djecu ili trudnoća završava pobačajem;
- V bračni par ako žena ima 35 ili više godina;
- osoba koja je sklona genetskim bolestima i planira dijete;
- ljudi koji imaju patološko pogoršanje mentalne aktivnosti s godinama;
- parovi koji su u krvnom srodstvu.
Kako funkcionira genetika
Rad liječnika s pacijentima započinje obiteljskom anamnezom. Kako bi se isključili etiološki čimbenici različitog oblika, pacijenta prvo pregledaju određeni stručnjaci.
Tek nakon što genetičar dobije rezultate pregleda i kompletnu obiteljsku anamnezu, dodjeljuje se dijagnostički program.
Metode genetskih istraživanja
U svom radu stručnjak koristi sljedeće dijagnostičke metode:
- probir genetskog tipa;
- DNA dijagnostika;
- istraživanje kromosoma;
- kariotip.
Ako govorimo o patologiji fetusa, tada su propisane dodatne metode istraživanja:
- biopsija materijala iz maternice;
- biokemijski marker majke;
Što se tiče invazivnih metoda, one se propisuju samo u najekstremnijim slučajevima. To je zbog činjenice da takve instrumentalne analize mogu utjecati na zdravlje djeteta.
Pravovremeno upućivanje para ovom stručnjaku može spriječiti razvoj teške patologije kod djeteta ranoj fazi fetalni razvoj. Pravilno planiranje bebe omogućuje, ako ne isključiti, onda minimizirati rizik od razvoja ozbiljnih bolesti i komplikacija. Potonje se ne tiče samo djeteta, već i njegove majke. Također treba napomenuti da, u ovom slučaju, govorimo ne samo o fizičko zdravlje bebe i roditelja, ali i o psihološkom.